CKDの主因:糖尿病性腎症と糸球体腎炎の解析
糖尿病はCKDと心血管疾患のリスクを増悪し、糖尿病性腎症は日本の透析導入の一次疾患中、第1位であります。
腎傷害の病因として、腎血行動態の変化や高血糖状態の持続によって引き起こされる細胞代謝・機能異常のメカニズムが疑われ、ポリオール経路活性化、活性酸素の増加、終末糖化産物(AGEs)の蓄積、レニン-アンジオテンシン系(RAS)の活性化が深く関わることが知られています。
一般的に知られる腎臓のレニンからアンギオテンシンIIおよびアルドステロン産生・作用系は、全身型RASと呼ばれます。一方、腎臓では糸球体傍細胞におけるレニン産生のほかに複数のRAS構成要素の発現が確認され、腎臓内RASと位置づけられます。
更に、腎臓内RASには、脈管系RASおよび尿細管間質系RASなどの局所RAS系の存在が示唆されています。様々な組織障害時には局所のRAS亢進が病態増悪に関与し、RAS系の活性化を抑えるアンギオテンシン変換酵素(ACE)阻害薬やアンギオテンシンII受容体(AT)拮抗薬(ARB)は、糖尿病性腎症治療の第1選択薬です。一方で、ACEやAT1受容体の多型が本症の増悪と深く関連することが知られており、腎臓内RAS系と糖尿病性腎症の病理学的クロストークには遺伝学的背景も影響を与えます。
マウスのレニンをコードする遺伝子はRen1, Ren2の2種類存在し、マウスにはRen1のみ(Ren1系統)あるいは両方の遺伝子(Ren1/Ren2)を有する系統が存在します。特にRen2は下顎腺のレニン発現において重要であります。
本研究では、局所RAS系が糖尿病性腎症の病態形成に果たす役割を解明するため、Ren1系統およびRen1/Ren2系統にSTZによる糖尿病を誘発後、腎臓内局所RAS系の発現を腎臓病理の動態と共に解析しました。
両系統のマウスともに、糖尿病誘発後に腎腫大、遠位尿細管および集合管の拡張が認められました。拡張にともない扁平化した上皮細胞の管腔側細胞膜にはレニンおよびアンギオテンシンIIの局在が比較的強く認められました。
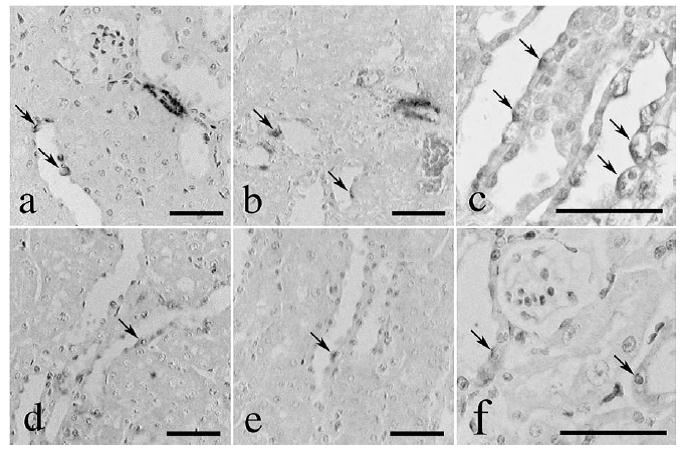
図. 糖尿病マウスにおけるレニンとアンギオテンシンIIの局在
レニン(a, b, c)。アンギオテンシンII(d, e, f).
レニンmRNAは、主に皮質部動脈および糸球体を中心に検出されましたが、他のRAS構成要素は(アンギオテンシノーゲン、ACE、AT1、AT2)のmRNAは検出されませんでした。両系統の比較では、Ren1系統がRen2系統よりも早期かつ重篤な腎病変を呈しました。
以上より、高血糖に伴う刺激は糸球体傍装置を介して遠位尿細管管腔へのレニン分泌を促し、尿細管上皮で局所RAS系を介してアンギオテンシンIIを産生し、腎病変の形成に参加していると考えております。また、Ren2遺伝子発現による病態抑制作用については、今後の更なる研究が必要です。
糖尿病性腎症制御には局所RASの制御が鍵を握っており、遺伝学的背景を考慮したオーダーメイド治療が重要であると考えられます。
糸球体腎炎の研究については、こちらをご覧ください。