木村 享史
1. ウマヘルペスウイルス1型の細胞内侵入機構
ウマヘルペスウイルス1型(EHV-1)はヘルペスウイルス科アルファヘルペスウイルス亜科に属し、ウマに鼻肺炎、流産、脳脊髄炎を惹き起こす病原体です。臨床上特に問題となる流産と脳脊髄炎では、妊娠子宮、中枢神経系の血管内皮細胞にウイルス感染が生じ、それに続発する血管炎、血栓形成、循環障害が病態発生に大きな役割を果たしています。従って、血管内皮細胞へのウイルス感染は流産、脳脊髄炎の発症において最も重要なステップと言えます。EHV-1脳脊髄炎の病態を再現する小動物モデルは残念ながら存在しません。そこで私たちはウマ大脳皮質より調整した脳微小血管内皮細胞の初代培養系を使用し(Hasebe R. et al. Arch Virol 151:775-86, 2006)、同細胞におけるEHV-1の感染様式を解析すると共に(Hasebe R. et al. Virology, 393:198-209, 2009)、EHV-1感受性を規定する宿主分子の解明を試みてきました。私たちの研究により、ウマ主要組織適合遺伝子複合体(MHC)クラスI分子が新たなウイルスレセプターとして同定され(Sasaki M. et al. Genes Cells 16:343-357, 2011)、さらにリガンドとなるEHV-1エンベロープ蛋白(図1)と、レセプター機能に重要なMHCクラスI分子のアミノ酸領域(図2)が明らかとなりました(Sasaki M. et al. J Biol Chem, 286:39370-39378, 2011)。また、CAGプロモーターの制御下で全身にウマMHCクラスIを発現するトランスジェニック(Tg)マウスを作製し、Tgマウスの肺は野生型マウスの肺に比較してより高いEHV-1感受性を示すことを報告しました(Minato E. et al. Vet Pathol 56:703-710, 2019)。

図1.EHV-1 の細胞内侵入機構。アルファヘルペスウイルスの細胞内侵入機構は、細胞表面へのウイルス粒子の吸着と、その後に起こる細胞内への侵入の2段階に大きく分けられる。EHV-1 の場合、エンベロープ蛋白gC が細胞表面のへパラン硫酸と結合することにより、ウイルスの細胞への吸着が促進される(1)。ウマの細胞(脳血管内皮細胞、E. Derm 等)では、エンベロープ蛋白 gD とMHCクラス I の相互作用により、ウイルスは細胞内に侵入する(2)。
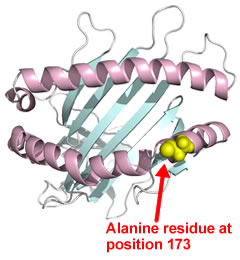
図2.ウマMHCクラス I の分子モデル。N 末端から 173 番目のアミノ酸は、α2 ドメインのα ヘリックス構造中の表面に露出した場所に位置しており、EHV-1 の結合領域がこのアミノ酸を含めた周辺領域に存在することが予想される。
2. EHV-1感染におけるノンコーディングRNAの役割
他のアルファヘルペスウイルスとは異なり、EHV-1脳脊髄炎において神経細胞へのウイルス感染は認められません。その一方で、EHV-1は三叉神経節の神経細胞に潜伏感染することが示唆されています。神経細胞におけるEHV-1の感染様式を解析する目的で、私たちは、ラットの縫線核由来神経細胞株Rn33Bにウマ MHC クラス I遺伝子を導入し、EHV-1感受性神経細胞株Rn33B-A68B2Mを作製しました(Minato E. et al. Microbiol Immunol 64:123-132, 2020)。本細胞株は温度感受性 SV40 T抗原を構成的に発現し、32℃で増殖・維持を行いますが、培養温度を37℃に上昇させると増殖を停止し、神経細胞へと分化するユニークな性質を有しています。EHV-1を感染させると、32℃の未分化状態ではウイルスの増殖が生じますが、神経細胞への分化によってウイルス遺伝子発現が著しく抑制され、ウイルス増殖が全くみられなくなります。本細胞株を用いた解析の中で、最近、私たちは、EHV-1の溶解感染において重要な役割をはたす前初期(immediate early; IE)遺伝子の5’非翻訳領域からアンチセンス方向に転写される長鎖ノンコーディングRNAを発見し、これをIEプロモーター関連ノンコーディングRNA(IE pancRNA)と命名しました(Maeda M. et al. Viruses 16(8):1195, 2024; 図3)。IE pancRNAはEHV-1を感染させた未分化Rn33B-A68B2Mにおいて豊富に発現し、EHV-1 ORF12蛋白の存在下でIE遺伝子の転写とウイルス増殖を促進します。現在、私たちは、このIE pancRNAの作用機序についてさらに研究を進めています。
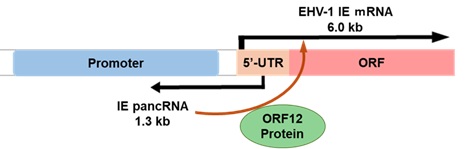
図3. EHV-1 IE 遺伝子の上流調節領域における pancRNA 転写の模式図
3. 結核と鼻疽の制圧プロジェクト(地球規模課題対応国際科学技術協力プログラム(SATREPS)2020~2024年度)
本プロジェクトでは北海道大学大学院獣医学研究院、人獣共通感染症国際共同研究所、結核予防会結核研究所、モンゴル国立感染症センター、モンゴル生命科学大学獣医学研究所の5機関が協働し、研究期間内に、モンゴルの動物とヒトにおける結核と鼻疽の蔓延状況を調査し,動物-ヒト間における病原体の伝達のリスクを明らかにしました。
当教室は、研究代表機関として、馬鼻疽の疫学調査と簡易診断キットの開発に従事しました。その結果、モンゴル国内で鼻疽が再興感染症として流行していることを示し(Erdemsurakh Ochbayar et al. J Vet Med Sci 82:1247-1252, 2020; Vet Pathol 57:807-811, 2020),モンゴルで分離された鼻疽菌のゲノムを初めて分子疫学的に解析しました(Ichikawa Y. et al. Infect Genet Evol 123:105616, 2024)。また,簡便かつ高感度な鼻疽菌の遺伝子検出法として乾燥LAMP法(Nakase M. et al. BMC Microbiol 25(1):36, 2025; 図4)とリアルタイムPCR法(manuscript in preparation)を、鼻疽の血清診断法として間接ELISA法(Ichikawa Y. et al. J Vet Med Sci. 87:394-401, 2025)とイムノクロマトグラフィー法(manuscript in preparation)を開発し,それらの有効性を検証しました。
これらの研究成果はモンゴルの統合獣医庁と保健省によって高く評価され,開発されたキットは,今後,診断のガイドラインに組み込まれる予定です。モンゴル国内でキットの生産が可能な体制も構築されており,臨床症例を用いた試験と検証がさらに進められています。
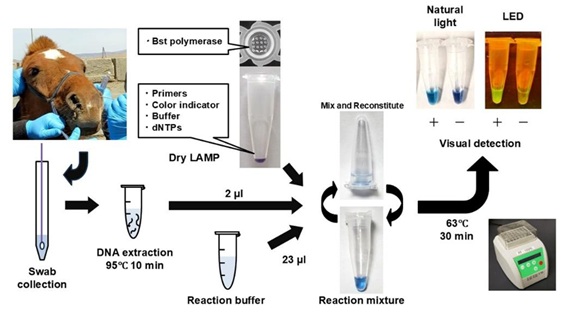
図4. 鼻疽菌と類鼻疽菌を特異的に検出する新規dry LAMP法









