尿細管間質病変の進行に関与するIL-1F6/IL-36α
CKDの病理像は、糸球体病変と尿細管間質病変に分けられます。一般的に、糸球体病変はCKDの初期より出現し、尿細管間質病変は後期に出現する傾向にあります。
特に後者は、後の腎機能悪化と強く相関するため、尿細管間質病変の程度の把握は患者の予後判定や治療方針決定に重要です。
当研究室では、糸球体腎炎モデルマウスの尿細管でInterleukin 1 family, member 6 (IL-1F6)/Interleukin 36 alpha(IL-36α)遺伝子が異所性に高発現することを発見しました。IL-1ファミリーは感染防御や炎症制御に重要な分子群であり、マウスでは約10種類(IL-1F1~11)の分子が知られています。本研究では、腎疾患モデルにおけるIL-1F6/IL-36αの発現動態を精査し、尿細管傷害マーカーとしての可能性を見出したのでご紹介します。
糸球体腎炎モデルマウスは対照のC57BL/6マウスよりも高い腎臓内IL-1F6/IL-36α mRNA発現を示し、それは病態の進行と共に増加しました。
腎炎モデルマウスの腎臓で、IL-1F6/IL-36α陽性反応は遠位曲尿細管から集合管にかけて上皮細胞の核および細胞質に認められ、一部の尿細管でIL-1F6/IL-36α陽性上皮細胞は重層化し、管腔脱落像を呈しました。

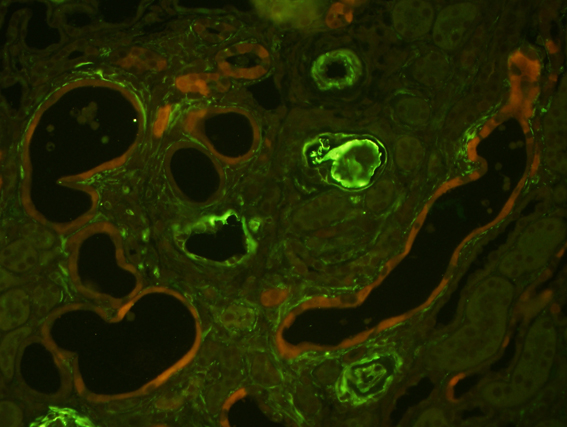
図. IL-1F6の局在。左(ホールマウント免疫染色)。右(ネスチン緑との多重蛍光抗体法)。
IL-1F6/IL-36α陽性尿細管周囲にはT細胞や筋線維芽細胞が集簇し、一部のIL-1F6陽性上皮細胞は間葉系・尿細管傷害マーカーであるNestinと共局在を示しました。腎炎モデルのみならず、ネフローゼ・糖尿病性腎症モデルマウスでも、腎臓内IL-1F6/IL-36α陽性尿細管数は尿細管傷害の進行と共に顕著に増加しました。さらに、腎炎モデルマウス尿中にIL-1F6/IL-36α蛋白およびmRNAの存在を確認し、IL-1F6/IL-36α発現細胞の脱落も明らかとなりました。
上記の解析に加えて、片側尿管結紮(UUO)を施したマウス腎臓(急性腎症害、腎線維化モデル)におけるIL-1F6/IL-36α発現を解析しました。腎臓UUO処置後24時間の腎臓において、IL-1ファミリーの中ではIL-1F6/IL-36αの遺伝子発現量が最も顕著に上昇しました。腎臓内IL-1F6/IL-36αの遺伝子・蛋白の発現量はBUNおよびCrと正の相関を示し、その相関係数はKim-1と同等でした。
腎炎モデルマウス同様、IL-1F6/IL-36α蛋白はUUO処置後12時間から拡張した遠位尿細管の上皮細胞に発現し、特に緻密斑から周囲の遠位尿細管上皮細胞に発現が波及していました。IL-1F6/IL-36α蛋白は、扁平化した遠位尿細管上皮細胞の細胞質および核に局在し、その上皮細胞の基底陥入や細胞間連結は乱れていました。
腎臓において、IL-1F6/IL-36αの受容体分子(IL-1RL2)は糸球体足細胞、近位尿細管上皮細胞、遠位尿細管上皮細胞、尿細管間質の血小板および浸潤細胞に局在していました。IL-1F6/IL-36α蛋白発現量は、腎炎マウス同様に病態進行と相関し、特に死細胞、炎症細胞や筋線維芽細胞の数と正の相関を示しました。
ゲノム編集技術でIL-1F6/IL-36αKOマウスを作出したところ、本マウスではUUO誘導性腎障害が軽減され、UUO処置後48時間における尿細管間質のCD3+T細胞およびGr-1+好中球の数は、野生型マウスよりも減少し、尿細管の拡張も軽度でした。
209/MDCTマウス遠位尿細管上皮細胞株において、IL-1F6/IL-36α発現はリポ多糖(LPS)刺激によって誘導されました。一方、検証したマウス由来培養細胞株6種において、IL-1RL2の発現はNIH3T3マウス線維芽細胞株にのみ維持されていました。NIH3T3はIL-1F6/IL-36α刺激後6時間からIL-6を産生しました。
このように、IL-1F6/IL-36αは傷害を受けた遠位尿細管上皮細胞で産生され、尿細管間質の炎症と線維化の進行に関与する“遠位尿細管上皮細胞の傷害マーカー”であるといえます。
また、IL-1F6/IL-36αはToll様受容体リガンド(LPSや細胞傷害関連分子パターン)によって誘導され、オートクリン・パラクリン様式でIL-1RL2受容体発現細胞に作用後、IL-6等を介して炎症誘導に関与すると考えられました。さらなる解析によって、IL-1F6/IL-36αの直接的・間接的な下流経路を模索しており、Prss35(コラーゲンリモデリング分子)、化学受容体や一次線毛関連分子が示唆されています。IL-1F6/IL-36αは遠位尿細管の形態変化や尿細管間質のリモデリングにも関与すると考えられます。
IL-36サブファミリーはα、β、γの3種類が知られており、各動物種の腎疾患における病態意義の解明と各リガンドあるいはその受容体ブロック戦略を見据えた更なる基礎研究を進める予定です。
本研究の一部は、科学研究費補助金(2009-10年, No21880002)、栗林育英財団(2009-10年)、北海道大学総長室重点配分経費・研究支援事業(2010年)、稲盛財団(2011年)の助成を受けて行っております。