木村 享史
1. ウマヘルペスウイルス1型の細胞内侵入機構
ウマヘルペスウイルス1型(EHV-1)はヘルペスウイルス科アルファヘルペスウイルス亜科に属し、ウマに鼻肺炎、流産、脳脊髄炎を惹き起こす病原体です。臨床上特に問題となる流産と脳脊髄炎では、妊娠子宮、中枢神経系の血管内皮細胞にウイルス感染が生じ、それに続発する血管炎、血栓形成、循環障害が病態発生に大きな役割を果たしています。従って、血管内皮細胞へのウイルス感染は流産、脳脊髄炎の発症において最も重要なステップと言えます。EHV-1脳脊髄炎の病態を再現する小動物モデルは残念ながら存在しません。そこで私たちはウマ大脳皮質より調整した脳微小血管内皮細胞の初代培養系を使用し(Hasebe R. et al. Arch. Virol. 151:775-86, 2006)、同細胞におけるEHV-1の感染様式を解析すると共に(Hasebe R. et al. Virology, 393:198-209, 2009)、EHV-1感受性を規定する宿主分子の解明を試みてきました。最近の私たちの研究により、ウマ主要組織適合遺伝子複合体(MHC)クラスI分子が新たなウイルスレセプターとして同定され(Sasaki M. et al. Genes Cells 16:343-357, 2011)、さらにリガンドとなるEHV-1エンベロープ蛋白(図1)と、レセプター機能に重要なMHCクラスI分子のアミノ酸領域(図2)が明らかとなりました(Sasaki M. et al. J. Biol. Chem., 286:39370-39378, 2011)。
現在は主に、ウマMHCクラスI遺伝子導入マウスの作製とそれを利用したEHV-1感染症の病態解析に取り組んでいます。

図1.EHV-1 の細胞内侵入機構。アルファヘルペスウイルスの細胞内侵入機構は、細胞表面へのウイルス粒子の吸着と、その後に起こる細胞内への侵入の2段階に大きく分けられる。EHV-1 の場合、エンベロープ蛋白gC が細胞表面のへパラン硫酸と結合することにより、ウイルスの細胞への吸着が促進される(1)。ウマの細胞(脳血管内皮細胞、E. Derm 等)では、エンベロープ蛋白 gD とMHCクラス I の相互作用により、ウイルスは細胞内に侵入する(2)。
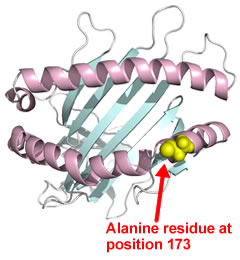
図2.ウマMHCクラス I の分子モデル。N 末端から 173 番目のアミノ酸は、α2 ドメインのα ヘリックス構造中の表面に露出した場所に位置しており、EHV-1 の結合領域がこのアミノ酸を含めた周辺領域に存在することが予想される。
2. 日本脳炎ウイルスの感受性を規定する宿主因子の解析
図3. JEV感染に対する日齢依存性抵抗性
日本脳炎は極東から東南アジア、南アジアにかけて広く分布するウイルス感染症です。原因となる日本脳炎ウイルス(JEV)はフラビウイルス科に属す蚊媒介性のウイルスで、ヒト、ウマに急性脳炎を惹き起します。中枢神経系内に侵入したJEVは神経細胞に強い向性を示します。実験的にフラビウイルスを動物に脳内接種した場合、新生仔は成熟した動物に比較して、より多くの神経細胞にウイルスが感染し、高い致死率を示します(図3)。この日齢依存性抵抗性(age-dependent resistance)に関しては不明な点が多く、私たちはこの現象に着目し、その分子基盤の解明を目的に、以下の2つの研究によりアプローチを行っています。
(1)CSM14.1細胞株における日本脳炎ウイルス感受性
CSM14.1細胞は、ラット14日胚中脳由来細胞に温度感受性SV40ラージT抗原遺伝子を導入して樹立された不死化細胞株で、31℃の培養温度では増殖するが、37℃に培養温度を上昇させると増殖を停止し、分化する性質を有しています。31℃にて培養を行った未分化細胞は37℃で培養した分化細胞に比較して高いJEV感受性を示すことから、私たちは、本細胞株をage-dependent resistanceのin vitroモデルとして解析しています(Kimura T. et al. Microbiol. Immunol., 57(10):723-31, 2013)。
(2)JEV感染に対するグリコサミノグリカンの影響
神経突起生成と神経細胞の遊走に関与するコンドロイチン硫酸Eユニットに着目し、神経向性ウイルスであるJEVの感染に置いてコンドロイチン硫酸Eユニットが果たす役割に関して検討を行いました。その結果、神経系細胞ならびにラット感染モデルにおいて、コンドロイチン硫酸EユニットはJEVの感染を増強する効果を示すことが明らかとなりました(Kim E. et al. Biochem. Biophys. Res. Commun., 409:717-722, 2011)。動物の脳では、コンドロイチン硫酸Eユニットは胎生期に最も豊富に存在し、成熟とともに量が減少することが知られています。私たちの研究により、脳内コンドロイチン硫酸に含まれるEユニットが、宿主のJEV感受性に影響を及ぼすことが示唆されました。
3. 動物に自然発生する腫瘍の分子基盤解明
近年、伴侶動物の高齢化とともに、腫瘍の発生率とそれによる死亡率が高くなっています。動物の腫瘍の多くはヒトにみられるものに類似していますが、なかには動物に特有の、ユニークな挙動を示す腫瘍が存在します。比較病理学的な見地から、それら腫瘍の発生メカニズムを明らかにし、がん細胞の分化、増殖に関連した制御機構を解明することを目指しています。現在は、犬の血管肉腫を研究題材とし、その発癌に関与が疑われる分子の解析を行っています。









